生物制药市场分析(下)
编写 嘉煌
主要问题
尽管我国生物制药具备进一步加快发展的有利条件与基础, 但也存在着诸多问题。这些问题大体可以归纳为以下几个方面。
资金问题
生物制药在战略新兴产业中属于盈利周期较长的产业。一个生物药物品种从研发到上市,一般需要5~10年时间。在国内,一个完全拥有自主知识产权的新药从研究开发到获准上市,需要耗费千万甚至上亿元的资金。在欧美发达国家,新药物投放市场前的平均成本大约为6亿美元。在这一阶段,企业的资金投入往往超过销售收入的20%。
药物的研究开发成本目前已经高到让企业难以为继的程度。从基础研发到成果转化的这一过程,就是企业要经历的一个被称之为“死亡谷”的危险阶段,而医药企业在这一阶段的“死亡率”高达40%至50%,缺少资金则是这些企业无法越过“死亡谷”的重要原因。
除了研发成本,厂房建设、仪器设备和高端人才的配置等也需要大量资金。海外较成功的生物制药公司从成立到盈利平均需花10年左右的时间,盈利之后业绩将出现非线性增长。另外,技术先导是医药产业的典型特征之一,企业必须拥有足够的投资强度以稳定技术输出才能获得发展。
生物制药产业高投入、高产出、高技术、高风险、长周期的特点,决定了其前期资本投入非常大。因此,世界上著名的生物制药企业大多位于科技强国。
中国是亚洲生物制药的“领头羊”,2013年研发支出为1600亿美元。总额看似不少,但平均到每个企业,数额却很有限,绝大多数生物制药企业研发投入较少。全球大多数制药企业的研发投入占销售额的 5%以上,有些甚至高达20%以上。而我国的生物制药企规模小,实力弱,加之投入比例低,绝对数额就少得可怜。资金投入严重不足,直接制约了研发新药的能力。
各国政府都十分重视生物药物的研发投入。为公众健康服务的美国国立卫生研究院(NIH)生物技术基础研究2015年的预算超过300亿美元;欧洲国家也都以调拨专款的形式支持生物技术发展。多年来,我国政府对生物制药产业不断给予资金扶持,对推动生物制药产业的发展起到了巨大作用。但对生物制药这只“吞金兽”来说,这些资金还很远远不够。
虽然科技部、发改委、财政部等相关部门以及各省市地方政府都在不断加大对生物制药产业的支持,曾多次下拨专项资金,但仍难以满足企业运行的资金需求,原因在于:首先,申报政府创新基金需要了解有关这种金融工具的具体知识,对于企业来说这是一种机会成本;其次,基金的审批手续严格而且复杂,时效性差;第三,创新基金的批准率低,基金总额少,批准立项中对企业的资助占需求总额的比例偏低。因此一个生物制药企业能否顺利成长,除了企业自身的盈利水平和政府扶植之外,还和融资渠道有着极为重要的关系。各路资本成为撬动产业快速发展的重要支点。
银行贷款仿佛是一个有效渠道,但小额贷款对企业来说是杯水车薪。银行为降低风险,一般会设置多种障碍,增加审批手续或需要企业提供必要的抵押。股票市场门槛太高难以涉足。我国私募资金基本没有,社会上为数极少的担保公司力量薄弱。即使有民间融资渠道,但企业承受不起较高的利息成本。高风险性使投入巨资的药物很可能不被社会认可,这就使得许多资金纷纷转移投资方向。创业投资不发达,资金缺乏,对我国生物制药产业的发展形成了极大的阻碍。在我国,95%以上的破产企业是由于资金链断裂而引起的。
鉴于我国生物制药企业融资难的问题,有专家建议政府设立“国家生物产业发展(投资)基金”,对新创办的生物企业实施税收优惠政策。政府要开拓思路积极鼓励企业成为生物制药的投资主体,由此而形成政府引导、企业主体和社会参与的多元化生物制药投资模式。政府要积极培育和建立风险投资新机制,引导相关投资机构加大对生物制药产业的投入,适时允许投资银行、信托投资公司、保险公司等机构发起设立风险投资基金。建立风险投资退出机制,让中国的资本市场提早介入新药研发领域,作为产业发展的接力捧。在世界各地的生物技术产业的发展中,风险投资都起到了极其重要的作用。同时,政府要发挥公共服务的功能,建立中小企业征信体系,鼓励相关的金融机构或部门向信誉良好的中小企业提供更多的资金支持,为中小企业的融投资提供政策支持。另外,生物制药企业要积极寻求与域外企业的合作与交流,吸引域外资金。生物制药企业要及时向关联企业提供相关信息,增加经营透明度,建立良好的品牌形象,以吸引民间资本。近几年创业板的推出在部分程度上缓解了生物制药企业的资金问题。
人才问题
在知识经济中,人是最活跃的因素。人和技术的结合将超越资本、设备、土地等生产要素,成为新世纪最重要的竞争武器。
生物制药属于知识密集型产业,对人才及其素质要求更高。我国从事生物技术产业研究、开发、生产和经营的人数仅相当于美国生物技术产业人数的1/4,人才储备不足。我国高校、研究所、生物园区的分布格局又造成了科研型人才呈现相对集中、分布不均衡的现象。偏生物工程与制药工程者较多,偏工艺设计者较少,综合性高素质科研人才缺乏。我国正处于与世界接轨的特殊发展时期,人才不足,已成为制约我国生物制药产业发展的瓶颈。
持续技术创新要求企业高层领导对技术发展方向具有独到的理解,能适时推动企业的技术创新进入新的轨道,并能对这一过程和技术创新的常态过程进行有效的管理。这就要求企业的高层领导应该既是生物技术领域的专家,又是一位出色的管理者。只有这样才能尽量降低新药研发所具有的高风险性,减少企业技术创新资源的无谓消耗,从而维持持续技术创新的基础和能力。在中国现阶段,这样的人才还非常少。
政府应鼓励科研机构、企业与高校联合培养生物技术人才,鼓励海外优秀人才申请和承担政府科研项目,鼓励生物科研机构公开向海内外招募人才,采取特殊政策吸引全球华人生物科学家回国。要加大向关键岗位和优秀人才收入分配的倾斜力度,完善人才评价和奖励制度。国内人才的培养应涵盖从事医学、生物学、药学等基础研究的人才,生物工程与制药工程的人才,信息技术人才,管理人才,金融人才以及维护知识产权的法律人才。
2008年,中央政府推出了“千人计划”(Thousand Talents program),旨在用5 到10 年时间引进2,000 位在中国出生的高端科技学者和专业人才。截止目前,该计划已吸引了来自美、日、德、英等国数千名高端人才,其中就包括普林斯顿大学明星教授、现在清华大学任职的施一公。在令人兴奋的机会和政府举动的感召下,另有约8万名生命科学人才也回到了中国。
虽然在西方受过训练的科学家和全球范围的伙伴关系有助于提升中国药物研发的能力,但就培养基础研究和新药研发所需的后备队实力而言,中国尚远远落后。中国没有什么大学和研究机构开展具有冒险心态的教学和实践,而冒险心态则是美国在生命科学领域创新的助推剂。不过有专家指出,中国也开始建立了几家这样的机构,其中包括由中国科学院和上海市政府共同建立的上海高等研究院(Shanghai Advanced Research Institute),以及北京生命科学研究所(National Institute of Biological Sciences),由百济神州公司的共同创始人王晓东任所长。这些机构仿照美国霍华德·休斯医学研究院(Howard Hughes Medical Institute)的模式运作。
创新问题
创新不仅仅是科学上的过程和学术上的丰富,更是生物制药业快速发展的关键。真正创造高额价值的是新药的技术创新和研究开发。与国际先进技术水平相比,我国生物制药企业的研发水平平均落后3—5年,90%以上的现有生物药物以仿制为主。由于大部分小企业缺乏研发能力,主要靠仿制生存,这就直接造成了药物研发和生产上的低水平重复局面,无谓消耗了大量资源,非常不利于我国生物制药产业的可持续发展。
国内生物制药业创新不足有客观原因,也有主观原因。客观上,企业规模小,资金短缺,设备落后陈旧,研发手段落后,企业难以过早进入风险高的新药研发中,不利于新产品研发。主观上,一方面,创新意识比较薄弱,缺乏前期市场调研和论证,不了解市场需求,对具有较好市场前景的项目开发不够。新药研发仍沿用学术工作的方式,从文献索引开始,实际上仍然在走模仿的路子,缺乏原创性。
另一方面,企业贪图便利,追求“短、平、快”的盈利模式,更愿意对现有产品进行改进和提高,极大地忽视了新产品的研究和研发。国外研制一个新药需要数年时间,平均花费数亿美元,而我国仿制一个新药只需几百万元人民币。2013年中国生物制药研发支出位居亚洲之首,而专利数仅9302件,日本为39797件,是我国的四倍多。
据报道,我国生物药物总销售额已经突破千亿元规模。但大多依靠进口,缺乏自主产品。我国企业虽然也生产了大量的生物药物,但是大多都是对外国成熟产品的仿制或追踪国外研究成果的产品。目前,在生物制药领域,美国、欧盟、日本等发达国家持有94%以上的专利,尤其是美国占有世界近六成生物药专利。包括我国在内的其他国家加起来也不足6%的专利占有,使得欧美发达国家在生物药领域具有绝对的垄断地位,也一度让我国患者形成了生物药“天价”的认知。比如乳腺癌治疗药物赫赛汀价格2万元/针,一个疗程高达30万元,这让很多普通家庭患者难以承受。国外药物售价昂贵,主要原因在于研发费用的高昂。目前,我国生物医药技术产品申报看似“活跃”,实际上完全属于自主创新者很少。由于缺乏自主知识产权,受技术条件等各种因素的影响,国内生物技术市场交易不活跃。
在生物制药界,具有成功潜力的企业往往拥有已申请专利或可申请专利的“贷现”技术或“平台”技术。所谓“贷现”技术或“平台”技术通常是指一些技术上的突破,使之在药物发现和开发中拥有新的研究开发能力,用之以开发多种药物靶化合物或开发不同的治疗领域。这类技术的例子有高流通量DNA测序、组合化学、DNA芯片等。与采用常规技术生产单一产品的公司比较,拥有上述技术的生物制药公司取得成功的机会更多。所以开发具有自主知识产权和市场前景的技术创新平台是我国生物制药企业的当务之急。
技术进步的重要标志是实现产业化运作。与发达国家相比,我国生物技术在产业化方面的差距还很大。虽然我国很多科研机构已取得了不少科研成果,甚至具有世界领先水平的成果,但却没有将这些成果转化为现实生产力。全国生物科技成果转化率普遍不到15%,西部还不到5%。许多新的研究成果的审核时期过长,甚至长期被搁置在保险柜中,无法进行有效的转换。技术如果不能转化为生产力,就无法对社会产生影响,造成资源浪费。在产业化扶持政策的有利时机下,我国的生物医药科研机构应该与企业互助合作,形成优势互补,从而加快产业化进程,提高新药的开发效率和竞争优势。在未来的发展中,生物医药必将引领新型发展模式,使开发、生产一条龙,既能发挥科研机构的技术优势又能发挥企业的资金优势,实现技术和资金的良性互动。实践证明,这种办法能使新药研发周期缩短3~5 年。
知识产权问题
知识产权保护关系到生物制药产品的创新。对生物制药企业而言,专利已取代设备、实验室和工厂成为最有价值的资产。以美国Amgin公司为例,它非常重视促红细胞生成素(EPO)基因专利的保护和开发应用,从而由一个濒临破产的企业一跃而成为美国生物工程医药领域的领头羊。
我国目前在医药产业领域普遍存在知识产权意识淡薄的现象,不尊重别人的知识产权,总是一味仿制或直接引进专利保护期外的技术。
由于法律不够健全,国内科研人员的知识产权保护和专利申报意识也不强,致使国内大量的科研成果和关键技术流失。政府要将我国的新药知识产权作为重点保护对象,加快健全相关知识产权保护体系。我国生物医药企业应该通过知识产权保护体系以防止技术创新成果流失,从而获取专利药的前期超额利润,收回技术创新的投入,为进一步发展积累资源。
政策问题
医药行业本身是一个易受政策影响的行业,积极的政策环境可以对行业发展形成有利支撑。生物制药的处方药属性明显,具有特殊的销售渠道,如医院等,因而更容易受到政策制度的影响。
我国各级政府为了扶持生物制药行业发展,不断出台相应的政策。2006年出台《国家中长期科学和技术发展规划纲要》,2009年颁发《促进生物产业加快发展的若干政策》。国务院于2010年10月在《国务院关于加快培育和发展战略性新兴产业的决定》中明确指出,将包含生物医药在内的生物产业列入国家战略性新兴产业。生物医药产业是国家“十二五”规划重点发展的领域之一。2011年中央经济工作会议进一步强调了把发展生物医药等战略性新兴产业作为产业结构升级的重要工作。2011年科技部又颁发《“十二五”生物技术发展规划》,支持生物制药行业的发展,积极引导生物医药产业向产业集群方向发展。《“十二五”生物技术发展规划》确定了生物医药发展的重点,包括生物信息、干细胞、基因治疗、生物芯片、蛋白药物、单抗克隆药物、治疗性疫苗等。2012年12月,国务院出台《生物产业发展规划》。规划指出,在2013-2015年,生物医药产业产值年均增速达到20%以上,推动一批拥有自主知识产权的新药投放市场,形成一批年产值超百亿元的企业,提高生物医药产业集中度和在国际市场中的份额。
地方政府也在不断加大对生物医药的投入力度,从政策和资金等各方面扶持生物医药产业。《上海市生物医药产业发展行动计划(2014-2017年)》发布,明确今后将继续推动上海建设成为亚太地区生物医药高端产品制造中心、商业中心和创新研发中心,到2017年底实现产业经济总量3500亿元,并形成一家销售收入超过1000亿元的旗舰企业,力争实现生物医药产业新一轮跨越式发展。
2014年10月29日,我国药品审评中心在网站发布了《生物类似药研发与评价技术指导原则》,意在规范我国生物类似药的科学开发与后续评价,推进我国生物制药的向前发展,满足生物治疗产品的可获得性和可支付性,从而为生物医疗产品的获得、可支付性提供保障。这也是我国首次颁发生物仿制药物指导原则,各大国内企业对此纷纷叫好。
如何评估一个生物医药技术的价值一直是困扰生物医药技术交易以及对生物医药技术进行投资决策的难题。中国技术交易所推出的“生物医药项目市场化评价体系”,综合运用管理学、经济学、金融学及技术创新学等理论,结合中国生物医药技术市场的现状,并参考国外成熟的生物医药技术市场化评价体系,构建起我国的生物医药专利技术的市场化评价指标体系和财务评价模型。
从中央到地方,从政府部门到行业组织,国内已形成一系列有关生物制药的政策文件。不过业内人士指出,一些政策缺乏可操作性,在财政支持上也力度不够,希望国家能继续给生物产业“松绑”和护航。
体制问题
由于药品研发、临床试验、审批过程和医保进入的周期太长,因而科技成果转化速度太慢。这严重制约了我国生物医药产业的发展,对中小企业尤其不利。特别是新药的审批速度和医保进入这两个环节,目前的时间非常长。有关数据表明,我国生物工程上游技术与国际先进水平比较接近,但下游体制则相差10年左右。国家应该采取措施加强下游研究,改革现行的生物制品审批制度。
要完善生物技术产品市场准入政策,建立让更多中国患者受益于创新性生物药的机制,如加速创建生物药的医保支付条件,或者推动采用政府/企业/患者等多方承担的共付机制,使更多患者可以有条件受益于创新型生物药。国家发改委已发出通知,决定从2015年6月1日起取消绝大部分药品政府定价,完善药品采购机制,发挥医保控费作用,药品实际交易价格主要由市场竞争形成。
在维护生物制药的安全性方面,要提高生产、流通与消费的信息透明度,在参考欧盟和WHO全球标准的基础上,建立健全能与国际接轨的生物医药质量标准及灵活有效的监管审批机制,加大对研究机构与生物企业的基础设施和安全措施的监督力度,完善评审、监测和监督程序。
要明确对创新型生物药和生物仿制药的定义,分别建立清晰透明的质量认定标准和监管审批制度(包含专利申请、 注册、命名到后期市场准入和监管),从而对两类药品的质量保证和患者安全保障进行把关。
另外,与生物制药产业发展相关的药品定价、转基因市场准入、政府采购、市场流通、国际贸易等方面的体制改革滞后,难以适应大规模产业化需要。
说到底,机制问体的根源在政府部门。改善机制首先要创建一个高效而富有创新精神的政府监管部门。虽然国家食品药品监督管理局(SFDA)在提供监管框架和鼓励创新方面取得了长足的进步,但它仍然是个需要充实人力和提升能力的年轻机构。美国食品药品监督管理局(Food and Drug Administration,简称FDA)有数千人管理医药项目,而中国食品药品监督管理局从事这些工作的却不到一百人。
产业化和规模化问题
我国的生物制药产业虽然获得了极大的发展,但是行业结构不合理,主要表现在企业数量多,规模小,缺乏具有国际竞争力的龙头企业;落后的生产技术、较低的生产水平、较高的生产成本,导致利润水平很低,难以形成规模效益;科技经济结合不紧密,未形成统一的格局,生产壁垒极低,企业无法拥有排他性的产权,这也就意味着无法获得高额的利润,影响企业的发展。
生物医药产业园区和孵化器是生物制药产业化和规模化的助推器,对促进我国生物医药产业快速、健康发展起到了重要作用。
中国生物医药产业园是伴随着高新区的发展而不断发展的。2009年5月新成立的泰州国家医药高新技术产业开发区,是中国首个国家级医药高新区。中国国家级高新区和经济技术开发区已经超过100个,均涉及生物技术产业。据不完全统计,中国现有省级以上的生物产业园400多个。为加快培育和发展生物产业,国家发改委自2005年以来,先后批准了四批共计22个国家生物产业基地,逐步在全国培育形成了长江三角洲、珠江三角洲和京津冀地区3个综合性生物产业基地,以及东北地区、中西部地区若干专业性生物产业基地的空间布局,促进生物企业、资金、技术、人才等要素向优势地区集中,加快生物产业向产业化和规模化方向发展,集群化效应初步显现。集群化发展是生物医药产业的一种有效避险机制和竞争利器。
深圳市是国家发改委2005年认定的首批3个国家生物产业基地之一,基地核心区位于该市坪山新区东北部,规划面积3.29平方公里。基地已引进24家生物科技企业,主要分布在生物制药、医疗器械、中医药、医药物流等领域,其中包括1家世界500强企业、6家上市公司,总投资约100亿元,2011年基地实现产值近30亿元。预计到2015年,新区生物产业产值将达到200亿元。到2020年,生物产业产值将达到1000亿元左右。届时,新区将真正成为深圳国家生物产业基地的核心区和示范区。
我国几乎每个省和直辖市都拥有或正在筹建生物医药产业园区。产业园区的建立有利于扶植中小企业的发展,弥补国内生物制药企业规模普遍较小、大型生物制药企业严重缺乏之不足,同时有利于上下游企业的关联配套,降低风险和成本。生物医药产业园区最初是由政府主导,可以在硬件、技术、资金上给予企业扶持和帮助,现在逐渐转向市场化。在投入方面,正在由政府、半政府投入向企业投入转变。产业园正逐渐专业化,比如混合型园区正在聚焦于某一专业领域,如小分子、肽类等。
但是,有些园区缺乏明确定位,园区内部缺乏系统规划。过于追求宏观规模,对产业结构调整、产业结构优化升级的意义认识不够。园区内各组成部分之间、各生产经营要素之间没有充分渗透,园区内部各经济实体之间缺乏有效的交流与合作,出现只有独立企业而没有产业链的现象。虽然园区数量众多,但普遍存在产业领域重叠、低水平重复生产现象,缺乏拳头产品、明确方向和特色模式,导致了低水平竞争甚至恶性竞争,一些生物制药企业也因此而陷入困境。除上海、深圳、北京、长春等一些大城市的生物医药园区形成较强实力外,大多数园区质量不高,没有达到国家和各地政府建设如此规模和数量的园区的初衷。
生物医药孵化器作为专业孵化器,为生物医药领域的中小企业提供专业化服务。这种以促进科技成果转化为目标的科技创业政策落实载体,是培育和发展生物医药战略性新兴产业的重要抓手。目前,我国共有生物医药孵化器42家,约占专业孵化器总数的10%,孵化器总数的3%。生物医药孵化器为在孵企业提供专业化的中试基地和专业化的技术平台,减少了初创企业设施的投入,加速了资源的集聚与整合,对促进生物医药领域的技术转移、成果转化、企业培育、产业发展发挥着重要作用,是落实国家自主创新战略、解决关系国计民生重大问题的新的载体工具。生物医药孵化器在我国发展时间尚短,在发展与运行过程中还存在一些问题与不足。专职专业技术人员缺乏,设备种类不全,能够使用的尖端设备少,孵化企业功能偏弱,孵化内容比较单一,服务资源整合力度不大,大部分孵化器在很大程度上还只是充当着房产公司与物业公司的角色。
位于京南固安的百肽谷生物医药孵化港,对接北京资源,通过整合人才、技术和资本等要素,建立产业孵化体系,促进产业发展,力争从园区孵化出自主研发的一类新药。与其他生物医药产业园区的不同在于,创新资本直接从产业链前期开始介入产业发展,打通产业链条,建立真正意义上的生物医药产业孵化器,实现科研成果的产业转化。华夏幸福基业相关负责人表示,这种产业项目的培育,通过成熟的评估机制,精挑细选,然后进行孵化,更像“种树”,需要深耕培育多年才能看到结果;而非“种麦子”,一年一收成,所关注的只是短期效益。目前,除了美国华人生物医药科技协会外,博雅干细胞集团、北京大学分子医学研究所、北京博辉瑞进生物科技有限公司、武汉海规生物科技有限公司、中美生物技术和制药协会等多个机构也已经入驻。其中,博雅干细胞集团是全世界目前在建的最大综合性干细胞库,北京大学分子医学研究所在固安建设的非人灵长类模式动物研究中心项目将成为国内级别最高、亚洲规模最大的动物实验中心。
生物仿制药
化学药通常是化学合成的,而生物药则通常是生物合成的。化学仿制药是原研药的复制物:分子量小,两者一模一样;生物仿制药只是原研药的类似物,无法一模一样。由于具有更大的分子量和复杂的结构,生物药的表征面临很大的挑战。即使全世界可能有的最先进的仪器设备全用上,也不可能将生物药的结构等特性完全表征清楚。这些特点也注定,生物仿制药不可能完全和原研药一模一样。即使是同一家公司生产的同一种生物药,不同批次也会有差异。即使是同一批次,在储存、流通的过程中,生物药(尤其是蛋白类药物)的结构和活性也不可避免地会有所变化。对于生物仿制药生产商而言,由于知识产权保护等多种原因,原研药公司所采用的生产工艺甚至是所采用的细胞系都会不清楚,这就更导致生物仿制药与原研药不会一样。另外,对于生物药而言,其生产及流通过程更加复杂,要求也更高,有许多步骤,细胞培养的条件(温度和营养)、产品的加工、纯化、储存和包装等各个环节都会影响产品的生产,整个过程中的微小差别都可能会对最终产品的质量、纯度、生物特性以及临床效果产生较大的影响。正是由于上述种种原因,虽然化学仿制药的英文是generic drug,但是生物仿制药并非biogeneric,而是biosimilar,因为生物仿制药只可能与原研药“相似”(similar),绝无可能一样。正是由于这个原因,我国有业内人士认为biosimilar应该被译为生物相似药,而非生物仿制药。所以在欧盟,对于生物仿制药,法规明确要求不允许自动替换原研药。
生物仿制药主要有“两高”的特点:即技术门槛高、投资门槛高。一般认为生物仿制药通常研发需要8-10年,比化学药仿制药3-5年要长很多,堪比化学原研药。世界最大的仿制药公司之一、著名跨国药企诺华旗下的山德士认为,一种典型的化学仿制药的仿制成本为2-3百万美元,而对于生物仿制药而言,这一数字则高达0.75-2.5亿美元,两者相差约百倍。因此进入者少,通常只有2-5个,而化学仿制药通常会大于10个;上市后,生物仿制药价格下降在10-30%,远低于化学药的25%-80%的下降率。
山德士依诺肝素生物仿制药上市2年多,价格只下降到原研药的70%,占领约50%的市场;EPO、GCSF等生物仿制药在欧洲3年平均价格下降到70%。而氨氯地平化学仿制药上市后12个月,价格下降到原研药40%,取得不到40%的市场;35个月后,价格下降到约10%,取得不到60%的市场。
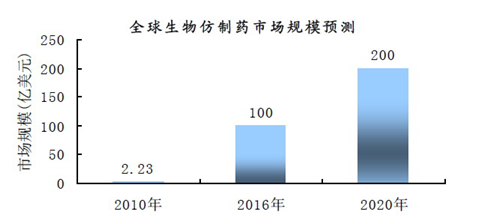
就全球而言,目前生物仿制药还基本处于起步阶段,生物仿制药目前所占市场份额可以说还微不足道。但是,一些生物专利药即将大量到期,给生物仿制药的发展带来巨大的市场空间。比如生长激素、促红细胞生成素、粒细胞击落刺激因子在欧洲已经到期,已有仿制药获批;干扰素、胰岛素即将到期,已有多家企业申报;肿瘤坏死因子受体抑制剂和单抗类抗肿瘤药物也有多家企业正在临床前或临床研究。据预测全球生物仿制药市场将从2010 年的2.23亿美元, 增长至2015年的100亿美元,2020年增长至200多亿美元,有望达到10 年90 倍的增长,未来10 年复合增长率有望达到56%。
中国企业一般规模较小,同时存在融资困难等各种不利因素,目前90%以上的生物制药企业是仿制国外产品。我国已经批准上市的生物药品原创仅百分之五左右,绝大多数为仿制药。
2020年生物仿制药市场规模预测
2016年生物医药行业并购TOP10
根据GEN网站的统计,2016年公布的全球生物医药并购Top10交易量为1956.06亿美元,较2015年的3039.26亿美元下降了36%。不过在不考虑2015年的Pfizer-Allergan项目下,2015年实际交易额为1439.26一美元。
以下是GEN网站统计的2016年生物医药领域并购Top10,其中包括药物开发公司,生命科学技术/工具企业、CRO等。
10.阿斯利康40亿美元收购 Acerta
2015年12月17日阿斯利康(AstraZeneca)对外表示:将以40亿美元的价格收购生物技术公司 Acerta Pharma 55%的股权,其中最初将支付价值达25亿美元的股票;在接下来的时间里,一旦收到美国监管部门对阿斯利康抗癌药acalabrutinib下达的首个审批通知将无条件支付15亿美元,具体支付时间取决于审批通知下发的时间或最迟于2018年年底;阿斯利康还享有以30亿美元收购Acerta Pharma剩余股权的权利,但将视具体情况而定。
2016年2月2日,双方宣布完成了这一交易。
9. 辉瑞52亿美元收购 Anacor
2016年5月16日,Anacor医药公司宣布将被辉瑞医药公司收购,此次并购交易总价值达52亿美元。辉瑞的目的旨在收购Anacor公司名为crisaborole的湿疹药物,后者是一种以PDE-4抑制剂为主要成分的凝胶,目前正处于FDA审批阶段,据辉瑞估计这有可能是一款年销售额逾20亿美元的重磅产品。
2016年6月24日,双方宣布完成了这一交易。
8.Lonza 55亿美元收购 Capsugel
2016年12月15日,瑞士的生物制药商Lonza宣布将收购美国Capsugel公司,后者是一家专业从事医疗包装和管理的公司,Capsugel总部设在美国新泽西州,生产处方药、非处方药及保健品所需的胶囊。
此次的交易预期可于2017年第二季完成,但仍需等待监管机构批准。
7. 艾伯维98.06亿美元收购 Stemcentrx
2016年4月28日,艾伯维(AbbVie)宣布将以近98.06亿美元收购位于南旧金山的癌症新药研发公司Stemcentrx,并向后者支付价值58.06亿美元的现金与股权(18.83亿美元+39.23亿股权)。视公司发展情况而定,Stemcentrx还有望获得40亿美元的里程碑款项。
2016年6月1日,艾伯维宣布已经完成了这项交易。
6. Mylan 99亿美元收购 Meda
2016年2月10日,荷兰非专利药生产商Mylan宣布以99亿美元的现金及股份形式收购瑞典制药公司Meda,其中包括72亿美元的股份以及Meda的净债务。
2016年8月5日,双方宣布完成了这一交易。
5. 昆泰104亿美元收购IMS
2016年5月3日,全球领先的医药健康产业战略咨询服务商IMS Health和全球最大的CRO公司昆泰(Quintiles)共同宣布,双方董事会已经批准最终达成的全股票对等合并协议,合并后的公司改名为Quintiles IMS Holdings, Inc。
据悉,这起并购的累计价值超过104亿美元。根据合并协议,每持有1股IMS股票的股东可以获得0.384股的昆泰普通股股票。合并交易完成后,IMS的股东将持有新公司全面摊薄后大约51.4%的股票,昆泰的股东将持有新公司全面摊薄后大约48.6%的股票。
2016年10月3日,双方宣布已经完成了这项交易,致力于变革创新药物的临床开发模式,更好证明创新药物在真实世界中的价值,促进新药开发取得更大的商业成功。
4. 辉瑞140亿美元收购Medivation
2016年8月22日,辉瑞宣布以140亿美元收购生产抗癌药物的生物科技公司Medivation,后者是一家位于旧金山的生物科技公司,拥有全世界最先进的治疗前列腺癌的药物恩杂鲁胺(Xtandi),每年销售额达20亿美元,并有望进一步实现翻番。
2016年9月28日,双方宣布已经完成这一交易。
3.Shire 320亿美元收购Baxalta
2016年1月11日,英国制药巨头Shire宣布已与美国罕见疾病制药商Baxalta达成协议,将以320亿美元的价格对Baxalta进行收购。 Shire公司罕见疾病的治疗收入将占合并后公司总收入的65%。收购意在扩大产品组合,并遍及100多个国家的销售,推动2020年实现预期200亿美元的年收入。
2016年6月3日,双方宣布已经完成这一交易。
2. 梯瓦388亿美元收购艾尔健仿制药业务(Actavis Generics)
2016年8月2日,全球仿制药销售的老大梯瓦制药(Teva Pharmaceutical)通过收购艾尔健仿制药业务 Actavis Generics 进一步增强其在仿制药市场的主导地位。据悉,艾尔健将获得334.3亿美元的现金预付款及1亿梯瓦股票(总价值53亿美元)。
2016年10月3日,梯瓦宣布完成了这项交易。
1. 拜耳660亿美元收购孟山都
2016年9月,历经4个多月的谈判,拜耳与孟山都达成收购协议。拜耳将以每股128美元,总金额约660亿美元收购孟山都。目前两家公司的股东已经批准交易,还需通过美国政府的反垄断审查批准,交割有望在2017年年底完成。